ENTALPI
A.
Mendefinisikan entalpi
Sebuah
dijelaskan oleh persamaan Q = ∆U. Ini akan mudah untuk memiliki persamaan
yang sama untuk proses isobarik. Mengganti persamaan kedua ke dalam hasil
pertama :
Q = ∆U + ∆( pV)
= ∆ ( U + pV )
Kuantitas U + p V adalah fungsi
keadaan sehingga dapat diberikan nama. Hal ini disebut dan dilambangkan dengan H. Oleh karena
itu proses isobarik dapat lebih ringkas digambarkan sebagai Q = ∆H.
Entalpi dan kapasitas panas spesifik isobaric
konstruksi matematika sangat berguna, karena ketika menganalisis proses dalam
sebuah situasi kerja nol terjadi ketika cairan yang mengalir pada tekanan
konstan. Dalam sebuah sistem terbuka, entalpi adalah jumlah yang berguna untuk
menggunakan untuk melacak kandungan energi dari fluida.
ü
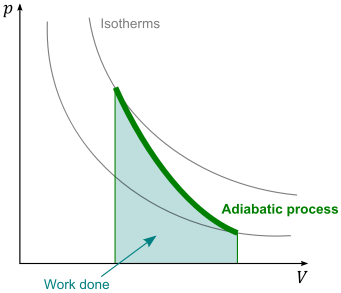
Proses adiabatik
Sebuah proses adiabatik adalah setiap
proses yang terjadi tanpa masukan atau output dari dalam suatu sistem (yaitu selama proses
sistem ini termodinamika terisolasi-tidak ada perpindahan panas dengan
lingkungan). Ini adalah kebalikan dari proses diabatic, di mana ada
perpindahan panas. Sebuah konsep kunci dalam
banyak yang cepat proses kimia dan fisika yang dijelaskan atau didekati
dengan cara ini. Proses tersebut biasanya diikuti ataudidahului oleh peristiwa
yang melakukan melibatkan .
Proses adiabatik dapat terjadi jika wadah sistem
memiliki dinding termal-terisolasi atau proses yang terjadi dalam waktu yang
sangat singkat, sehingga tidak ada kesempatan untuk pertukaran panas yang
signifikan. Meskipun istilah dan
isokalori seringkali dapat dipertukarkan, Proses adiabatik dapat dianggap
sebagai bagian dari subset pelengkap
sisa proses isokalori menjadi proses di mana perpindahan panas bersih tidak
menyimpang regional seperti dalam kasus ideal dengan media konduktivitas termal
terbatas atau tidak ada kapasitas termal.
Dalam proses ireversibel adiabatik, dQ = 0 tidak
sama dengan TDS (TDS> 0) di mana Q adalah energi panas, T adalah temperatur,
dan S adalah entropi. dQ = TDS = 0 berlaku untuk proses reversibel saja.
Sebagai contoh, sebuah batas adiabatik adalah batas yang kedap
perpindahan panas dan sistem dikatakan adiabatik (atau termal) diisolasi,
sebuah dinding terisolasi mendekatisuatu batas adiabatik. Contoh lain adalah yang merupakan suhu yang akan dicapai
oleh dengan tidak adanya kehilangan
panas ke lingkungan. Sebuah proses adiabatik yang juga disebut
. Sebaliknya, proses adiabatik yang ireversibel dan ekstrak pekerjaan
tidak ada dalam proses, seperti tarik
kental, maju menuju perubahan non-negatif entropi.
Satu berlawanan ekstrim-yang memungkinkan
perpindahan panas dengan lingkungan, menyebabkan suhu tetap konstan-dikenal
sebagai . Karena suhu termodinamika
ke , proses isotermal adalah konjugasi
untuk proses adiabatik untuk transformasi reversibel.
Sebuah transformasi suatu sistem termodinamika
dapat dianggap adiabatik ketika itu cukup cepat bahwa tidak ada panas yang
signifikan ditransfer antara sistem dan luar. Pada ekstrim yangberlawanan,
sebuah transformasi dari suatu sistem termodinamika dapat dianggap isotermal
jika cukup lambat sehingga suhu sistem tetap konstan dengan pertukaran panas
dengan luar.
Istilah "adiabatik" secara harfiah
berarti dilewati, berasal dari akar Yunani ἀ-("tidak"),
διὰ-("melalui"), dan βαῖνειν ("lulus"); etimologi ini
sesuai di sini untuk ketiadaan
B.
Adiabatik pemanasan dan pendinginan
Perubahan adiabatik suhu terjadi karena
perubahan dari sementara tidak menambah atau mengurangi
setiap . Sebaliknya, adalah proses untuk gas ideal.
Pemanasan adiabatik terjadi ketika tekanan gas yang meningkat dari
pekerjaan yang dilakukan di atasnya oleh lingkungannya, misalnya . mengandalkan pemanasan adiabatik saat
langkah kompresi untuk meningkatkan suhu cukup untuk menyalakan bahan bakar. Pemanasan
adiabatik juga terjadi di ketika turun, misalnya, dalam atau
atau angin mengalir menurun
selama pegunungan. Ketika sebidang udara turun, tekanan pada peningkatan paket.
Karena ini peningkatan tekanan, volume paket ini menurun dan suhu yang
meningkat, sehingga meningkatkan energi internal.
Pendinginan adiabatik terjadi ketika tekanan zat menurun karena tidak
bekerja pada sekitarnya. Pendinginan adiabatik terjadi di dengan
dan , dan ini dapat membentuk atau
jika udara didinginkan di bawah .
Ketika tekanan diterapkan pada sebidang menurun udara, udara dalam paket
diperbolehkan untuk memperluas, dengan meningkatnya volume, suhu turun dan
energi internal berkurang.
Pendinginan adiabatik tidak harus melibatkan
cairan. Salah satu teknik yang digunakan untuk mencapai suhu yang sangat rendah
(seperseribu bahkan sepersejuta derajat di atas nol mutlak) adalah , di mana perubahan pada bahan magnetik yang digunakan untuk
menyediakan pendinginan adiabatik. Juga, isi dari (untuk urutan pertama) dapat digambarkan
sebagai cairan pendingin adiabatik (Lihat -
)
Magma naik juga mengalami pendinginan adiabatik
sebelum letusan, sangat signifikan dalam kasus magma yang naik dengan cepat
dari kedalaman besar seperti
Perubahan suhu tersebut dapat diukur dengan
menggunakan atau untuk proses atmosfer.
Proses Tidak ada benar-benar adiabatik. Banyak
proses yang dekat dengan adiabatik dan dapat dengan mudah didekati dengan
menggunakan asumsi adiabatik, tapi selalu ada beberapa kehilangan panas, karena
tidak ada isolator yang sempurna ada.
C.
Ideal gas (proses reversible)
Untuk zat yang sederhana, selama proses
adiabatik yang meningkat volume, dari substansi kerja harus menurunkan
Persamaan matematika untuk menjalani
(yaitu, tidak ada generasi entropi) reversibel proses adiabatik adalah
PVᵞ = constant
di mana P adalah tekanan, V adalah atau dan ᵞ = CP / CV = f + 2 / f
CP
menjadi untuk tekanan konstan, Cv menjadi
panas khusus untuk volume konstan, γ adalah
, dan ϯ adalah jumlah (3 untuk
gas monoatomik, 5 untuk gas diatomik).
Untuk gas ideal monoatomik, γ=5/3, Dan untuk gas diatomik (seperti ,
komponen utama dari ) γ=7/5. Perhatikan bahwa rumus di atas
hanya berlaku untuk gas ideal klasik dan tidak
atau .
Untuk proses adiabatik reversibel, juga benar
bahwa
P1-ᵞTᵞ
= constant
VTf/2 = constant
di mana T adalah temperatur absolut, Hal ini juga dapat ditulis
sebagai :
TVᵞ-1
= constant
Tidak ada komentar:
Posting Komentar